Methodische Anweisungen
Einführung
Die chronische Obstipation ist eine häufige Erkrankung. Sie tritt als aperistaltisches (z.B. Morbus Hirschsprung) oder hypoperistaltisches (z.B. Hypoganglionose) Syndrom bei Kindern und Erwachsenen auf. Mittels enzymhistochemischer Methoden ist eine eindeutige Zuordnung der verschiedenen Ursachen einer chronischen Obstipation möglich. Nachfolgend werden die Technik und die diagnostischen Charakteristika dargestellt.
Labor-Methodik
Die Methodik der enzymhistochemischen Diagnose von Motilitätsstörungen des Darmes beginnt mit der Entnahme von Schleimhaut-Biopsien des Rektums (z.B. Frage nach Morbus Hirschsprung im Säuglingsalter) oder laparoskopisch gewonnenen seromuskulären Darmwand-Biopsien aus verschiedenen Höhen des Kolons resp. Abschnitten des Dünndarmes (z.B. Fragestellung nach Hypoganglionose oder Myopathie).
Für die Hirschsprung Diagnostik werden mit Pinzette und Schere idealerweise Pfefferkorn-grosse Rektumschleimhaut Biopsien aus den Höhen 0.5-1cm, 2cm, 4cm und 6-8cm, oberhalb der Linia serrata resp. dentata entnommen. Die distalste Biopsie wird zum Ausschluss eines ultrakurzen Morbus Hirschsprung aus dem unmittelbaren anorektalen Übergang gewonnen. Weniger kinderchirurgisch sondern eher gastroenterologisch geschulte Ärzte verwenden zur Biopsie-Entnahme eine Biopsie-Zange oder eine Biopsie-Sonde.
Die Gewebeproben werden ohne weitere Flüssigkeitszugabe in ein trockenes Eppendorf Röhrchen an die Innenwand gegeben und mit der Entnahmelokalisation, sowie dem Namen des Patienten beschriftet. Die Röhrchen werden anschliessend in Kohlesäureschnee bei -80°C eingefroren. In dieser Form ist das Gewebe transportfähig. Ist das enzymhistochemische Labor in ca. 4 -6 Stunden erreichbar, können die Biopsien auch auf Wassereis direkt dorthin transportiert werden.
Die Biopsien werden aufgetaut oder frisch auf Kryostattischen rechtwinklig (orthograd) zur Schleimhautoberfläche aufgebracht. Die Stabilisierung der Gewebeprobe erfolgt mit Tissue-Tek oder Eiweiss vom Hühnerei und anschliessendem Einfrieren mit Kohlensäureschnee/ Trockeneis. Die Menge des Tissue-Tek ist so zu bemessen, dass nicht mehr als ein Viertel der Gewebeprobe davon bedeckt ist. Gewebe, die total in Tissue-Tek eingebettet sind, insbesondere kleine Gewebestücke, lassen sich schwer schneiden, da durch gesteigerte elektrostatische Kräfte die Schnitte aufgerollt werden.
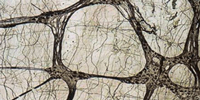
Nach dem Aufblocken der Biopsien werden 15μm dicke Kryostatschnitte hergestellt. Die Schnitte werden auf Objektträger bei Zimmertemperatur aufgefangen. Durch den Tauvorgang auf dem Objektträger gehen 70-75% des Schnittvolumens verloren, wodurch ein ca. 4μm dicker Schnitt resultiert. Es werden Schnittserien von 5-6 Schnitten auf 6 Objektträger verteilt. Nach dem sechsten Objektträger wird die nächste Schnittserie wieder auf Objektträger 1 aufgezogen. In der Regel sind 4-5 Schnittserien pro Biopsie und Objektträger möglich, je nach der Grösse der Gewebeprobe. Die ersten zwei Objektträger dienen der Acetylcholinesterase Reaktion. Ein Schnitt wird zusätzlich zur Orientierung mit Hämalaun gefärbt, während der zweite Schnitt ohne Gegenfärbung zur Beurteilung des Parasympathicotonus dient. Am Schnitt Nummer 3 wird eine Laktatdehydrogenase Reaktion durchgeführt. Objektträger 4 ist für eine Bernsteinsäure-Reaktion (Succinatdehydrogenase) vorgesehen. Objektträger Nummer 5 dient einer Nitroxid-Synthase (NOS, synonym zu NADH Diaphorase) Reaktion. Der sechste Objektträger ist für eine Pikrosiriusrot-Färbung vorgesehen. Der Pikrosiriusfärbung geht eine Delauney Fixierung von 50 Minuten voraus. Für eine optimale Siriusrotfärbung ist ein ausreichender Perchlorsäure-Zusatz erforderlich, die Färbung fällt sonst zu wenig kontrastiert und rot aus.
Die Schnitte trocknen bei Zimmertemperatur innerhalb weniger Minuten. In getrocknetem Zustand sind die Schnitte bezüglich der Enzymreaktion relativ stabil. In diesem Zustand können die Schnitte auch versandt werden ohne zusätzliche Kühlung.
In der Regel wird die gesamte Biopsie aufgeschnitten, um die optimalen Bedingungen für eine ausreichende Beurteilung zu gewährleisten.
Die getrockneten Schnitte können im Kühlschrank bei 4°C, z.B. über ein Wochenende, ohne grösseren Verlust von Enzymaktivität gelagert werden.
Enzymhistochemische Reaktionen
Das Inkubationsmedium für eine Azetylcholinesterase (AChE)-Reaktion nach Karnovsky und Roots wird im Wasserbad auf 37°C erwärmt. Gleichermassen wird mit dem Medium für Laktat-Dehydrogenase (LDH), Bernsteinsäure-Dehydrogenase (SDH) und Nitroxid-Synthase (NOS) verfahren. Anschliessend erfolgt die Inkubation der Schnitte in einer Hellendahl-Küvette im Schüttelbad. Die Dehydrogenasen erfordern eine Inkubationszeit von 8-10 Minuten. Die AChE Reaktion erfordert 90 Minuten Inkubationszeit. Wir bevorzugen die ursprüngliche Methode der AChE Darstellung von Karnovsky und Roots, da sie zuverlässiger und stabiler ist als die Schnellmethode.
LDH ist ein zytoplasmatisches Enzym, welches optimal Nervenzellen darstellt. Dem gegenüber ist die SDH ein mitochondriales Enzym, dessen Darstellung den Reifezustand der Nervenzellen zu beurteilen erlaubt. Die NOS Reaktion stellt alle Nervenzellen unabhängig vom Reifegrad dar.
Die Rezepte der enzymhistochemischen Methoden sind separat im Detail beschrieben. Es besteht auch die Möglichkeit auf bereits formulierte enzymhistochemische Reaktionsansätze zuzugreifen: Districhem, Oberwilerstrasse 10, CH 4103 Bottmingen, Fax +41 61 421 51 91. Dieser Weg ist vor allem dort zweckmässig, wo nur vereinzelte Untersuchungen von Darmschleimhaut – oder Darmwand-Biopsien anfallen.
Literatur:
Pathobiology 2005, 72;95-98
Meier-Ruge & Bruder, Histopathology of Chronic Constipation, S. Karger Basel, pp39-42 (2012)