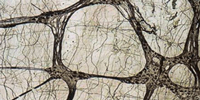
Laktatdehydrogenase (LDH), Succinatdehydrogenase (SDH), Nitroxidsynthase (NOS)
Zunächst werden die in Aliquots eingefrorenen Reagenzien für die Laktatdehydrogenase, Succinatdehydrogenase sowie Nitroxidsynthasereaktion aufgetaut und auf 37°C erwärmt. Nach Erwärmen folgt Co-Enzym-Beigabe: 1 Spatelspitze NADH für die Laktatdehydrogenasereaktion zugeben. Dann wird 2ml TNBT (Tetranitroblau-Tetrazolium-Chlorid) zugegeben und die Lösung gemischt und filtriert. Der Filtrationsschritt kann eventuell weggelassen werden. Die leere Flasche des Mediums wird als Markierung vor die Kuvette gestellt. Für die SDH Reaktion folgt gleiches Vorgehen, 2 Spatelspitzen Co-Enzym NADH beigeben, mischen und filtrieren.
Bei der NOS Reaktion werden 3 Spatelspitzen Co-Enzym beigegeben, sowie 500 Mikroliter (0.5ml) TNBT. Die Lösung wird wiederum gemischt und filtriert. Diese Arbeiten müssen unter dem Abzug durchgeführt werden. Anschliessend werden die für die NOS Reaktion vorgesehenen Schnitte in Paraformaldehyd bei 4° C 12 Minuten leicht fixiert und 3x mit PBS gespült.
Die Filter werden im Spezialabfall entsorgt und dann alle Objektträger in die entsprechenden Lösungskuvetten der drei Dehydrogenasereaktionen gestellt. Die Kuvetten inkubieren im vorgewärmten Wasserbad bei leichter Bewegung bei 37°C für ca. 12 Minuten. Nach ca. 12 Minuten folgt die erste Kontrolle unter dem Mikroskop. Dafür werden die Schnitte aus der Reaktion genommen, auf der Unterseite abgetrocknet und im Mikroskop ohne Deckglas betrachtet. Wenn die Färbung der Ganglien ausreichend vorangeschritten ist, dann werden die Lösungen in Spezialabfallcontainer dekantiert und die Schnitte in den Kuvetten 3x mit Aqua dest. oder demin. gespült und anschliessend in 4% Formalin für mindestens 20 Minuten zum Stoppen der Enzymreaktion fixiert, anschliessend gut gespült und nach aufsteigender Alkoholreihe eingedeckt mit Pertex.
-

Wasserbad vorwärmen -

LDH Aliquot unter warmem Wasser auftauen -

LDH Schnitte in Kuvette platzieren -

LDH Kuvette in Wasserbad platzieren -

LDH Die Färbereaktion wird vor dem Stoppen unter dem Mikroskop kontrolliert -

LDH Die Färbereaktion wird vor dem Stoppen unter dem Mikroskop kontrolliert -

LDH Monitoring -

LDH11 Monitoring IV -

LDH Monitoring
Sobald die Reaktion eine ausreichende Intensität aufweist, wir die Reaktion mit Formaldehyd gestoppt.