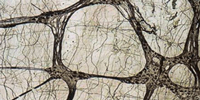
NADPH-Diaphorase (NOS)
11. Kryostatschnitte, 15um dick, auf Polysine Objektträger, lufttrocknen. Schnitte können bei 4 °C im Kühlschrank in einer verschliessbaren Mappe/Box aufbewahrt werden.
12. Schnitte fixieren in 0,5% Paraformaldehyd in PBS bei 4 °C, 12 min.
13. Fixierte Schnitte 3 x mit PBS spülen.
14. Inkubation in Gebrauchmedium NOS bei 37°C im Wasserbad, 15 min.
15. Spülen mit Aqua demin.
16. Fixieren in phosphatgepuffertem 4% Formalin, pH 7,0, 20 min.
17. Spülen in Leitungswasser
18. Aufsteigende Alkoholreihe, Xylol und mit Pertex eindecken.
Herstellung von Gefriermedium und Fixierlösung
PBS (Phosphate Buffered Saline 0,01 - 0,025 molar), pH 7,4 oder Phospatpuffer (siehe Anhang) ist in der Regel in Histologielabors gebrauchsfertig erhältlich
0,5% Paraformaldehyd in PBS: 10 g Paraformaldehyd in 2000ml PBS über Nacht bei Raumtemperatur ansetzen, wiederholt schütteln, braucht etwa 24h zum Lösen. Kann bis etwa 1 Jahr im Kühlschrank gelagert werden.
(Eventuell eine 4 %ige Stammlösung (durch Aufkochen lösen) herstellen, da Paraformaldehyd schwer löslich ist. Diese Stammlösung dann für den Gebrauch 1 : 8 (10ml Stocklösung/70ml PBS) zur Gebrauchslösung verdünnen).
| PBS, (Phosphate Buffered Saline 0,01 – 0,025 molar), pH 7,4 | 1000 ml |
| oder Phospatpuffer (siehe Anhang) Tetranitroblau-Tetrazoliumchlorid, vorgelöst |
5 ml |
(TNBT Fluka 87961. 250 mg TNBT in 5 ml Dimethylformamid vorlösen und tropfenweise unter Rühren zum PBS geben. Vorsicht TNBT kann ausfallen)
20 Portionen à 50 ml tiefgefrieren.
Substrat ist mehrere Monate bei -20°C haltbar.
Gebrauchslösung
Medium unter fliessendem warmem Wasser auftauen und auf ca. 37°C aufwärmen lassen.
2 - 3 Kleinspatelspitzen NADH, b-Nicotinamide adenine dinucleotide reduced Disodium salt (Fluka 43420) zugeben, mischen und filtrieren
Unbefriedigendes Ergebnis
pH kontrollieren! Evt. an einer Schnittreihe mit pH 7,0, 7,2, 7,4, 7,6 optimieren.
Eventuell 1 - 2 ml TNBT Lösung (250 mg TNBT in 20 ml Dimethylformamid) zusetzen.